ALCANOS
Los alcanos son hidrocarburos, es decir que tienen solo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados.
Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es la causa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma:
donde cada línea representa un enlace covalente. El alcano más sencillo es el metano con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano...
Nomenclatura
La nomenclatura IUPAC (forma sistemática de denominar a los compuestos) para los alcanos es el punto de partida para todo el sistema de nomenclatura. Se basa en identificar a las cadenas hidrocarbonadas. Las cadenas de hidrocarburos saturados lineales son nombradas sistemáticamente con un prefijo numérico griego que denota el número de átomos de carbono, y el sufijo "-ano".
Alcanos isómeros
Alcanos isómeros
| Los alcanos son compuestos con hibridación sp3 en todos sus carbonos. Los cuatro sustituyentes que parten de cada carbono se disponen hacia los vértices un tetraedro. Las distancias y ángulos de enlace se muestran en los siguientes modelos. 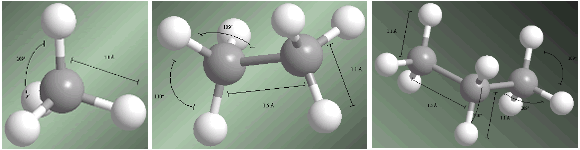 Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son líquidos. Alcanos de mayor número de carbonos son sólidos a temperatura ambiente. Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales. |
El metano, etano y propano son los únicos alcanos con las fórmulas CH4, CH3CH3 y CH3CH2CH3. Sin

Isómeros del butano
embargo, existen dos alcanos de fórmula C4H10; el butano y el 2-metilpropano. Estos alcanos de igual fórmula pero con diferente estructura se llaman isómeros.
Existen tres isómeros de fórmula C5H12. El isómero lineal se llama n-pentano. Los ramificados son el isopentano (2-metilbutano) y el neopentano (2,2-dimetilpropano).

Existen cinco isómeros constitucionales de fórmula C6H14:

A medida que aumenta el número de carbonos crece de forma exponencial el número de isómeros. Existen más de 360 000 isómeros con la fórmula C20H42 y más de 62 millones con la fórmula C40H82.
Propiedades físicas y químicas de los alcanos
Propiedades Físicas
Puntos de ebullición suelen ser bajos y crecen al aumentar la longitud de la cadena. Esto explica que el propano sea gas y el hexano líquido. Los alcanos son insolubles y son gases a temperatura ambiente de bajo peso molecular.
Propiedades Química.
Los alcanos reaccionan muy poco. La combustión puede ser completa o incompleta.
La combustión es completa cuando el oxígeno es abundante.
La combustión es incompleta cuando el oxígeno es escaso.
Isomería
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula química, es decir, iguales proporciones relativas de los átomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
REACCIOMES DE LOS ALCANOS
Mecanismo de la Halogenación
Halogenación del metano: reacción global
La halogenación del metano es una reacción que transcurre con formación de radicales libres y tiene lugar en tres etapas.
Etapa de iniciación
En el primer paso de la reacción se produce la rotura homolítica del enlace Cl-Cl. Esto se consigue con calor o mediante la absorción de luz.
Primera etapa de propagación
Se trata de una etapa ligeramente endotérmica que consiste en la sustracción de un hidrógeno del metano por el radical cloro formado en la etapa anterior, generándose el radical metilo.
Segunda etapa de propagación
Durante la misma el radical metilo abstrae un átomo de cloro de una de las moléculas iniciales, dando clorometano y un nuevo átomo de cloro. Dicho átomo vuelve a la primera etapa de propagación y se repite todo el proceso.
Etapa de terminación
Tiene lugar cuando se agotan los reactivos, entonces los radicales que hay en el medio se unen entre si.

CONBUSTION DE LOS ALCANOS
El proceso de la combustión
La combustión es un proceso general de todas las moléculas orgánicas, en la cual los átomos de carbono de la molécula se combinan con el oxígeno convirtiéndose en moléculas de dióxido de carbono (CO2) y los átomos de hidrógeno en agua líquida (H2O). La combustión es una reacción exotérmica, el calor desprendido se llama calor de combustión y en muchos casos puede determinarse con exactitud, lo que permite conocer el contenido energético de las moléculas.
Reaccion de combustión ajustada
Estabilidad de isómeros
Comparando calores de combustión de alcanos isómeros se observa que sus valores no son iguales. Así el 2-metilpropano desprende en su combustión -685.4 kcal/mol, mientras que el butano desprende -687.4 kcal/mol. Estos datos demuestran que el butano tiene un contenido energético superior al 2-metilpropano y por tanto es termodinámicamente menos estable.
McMurry, J., 2001. Química Orgánica. 5a. edición. Internacional Thomson Editores, México. Carey, F. A.: Química Orgánica. Ed. McGraw-Hill, 1999
Fessenden, R.J. y Fessenden
Bibliografia
S.J., 1993. Química Orgánica. Grupo Editorial Iberoamérica, México
S.J., 1993. Química Orgánica. Grupo Editorial Iberoamérica, México



No hay comentarios:
Publicar un comentario